周期表17族のハロゲン元素は、有毒なことで有名ですね。
反応性が高く有毒な、フッ素、塩素、臭素、ヨウ素たちは、実は毒だけでなく私たちの生活になくてはならない存在だったりします。
高校化学の復習にのぞいてみましょうか?
ハロゲンとは
周期表の右から2番目の列である、17族の元素のことを「ハロゲン」と呼びます。
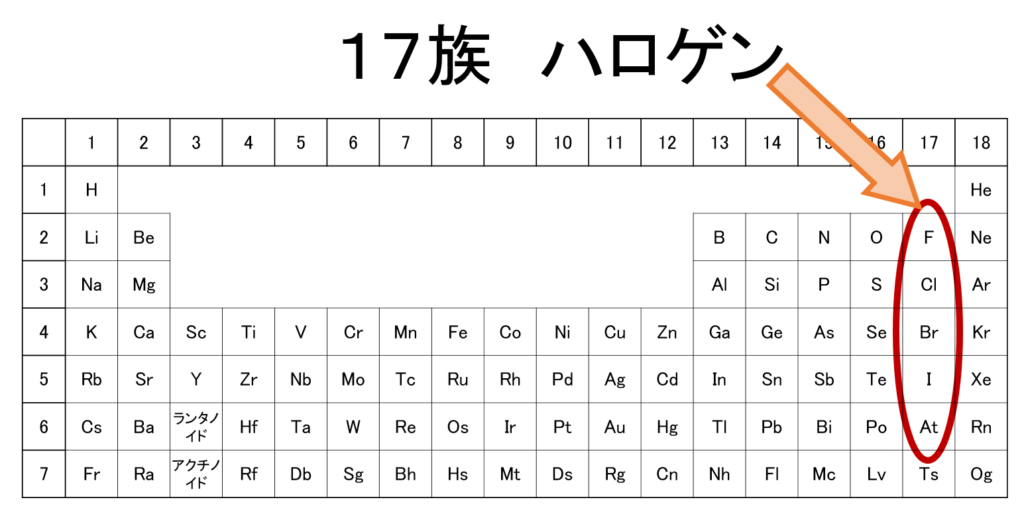
なぜ、ハロゲンという呼び名なのかというと、語源はギリシャ語からで
ギリシア語の「塩」を意味するalosと、
「生ずる」を意味するgennanに由来してhalogensとよばれるようになったそうです。
周期表は、列ごとに似た性質をもつことが知られています。
ハロゲンには、どのような特徴があるのでしょうか。
ハロゲンの特徴
二原子分子で存在する
ハロゲン族元素の原子は、価電子を7個もっています。
単原子では、閉殻構造にならないので、安定しません。
お互いに電子を1つ共有すると、それぞれの殻で、電子数を8にすることができます。
安定した状態で存在するために、2人で1つのバディを組んでるような感じがしますね。
特有の色を示し、有毒である
フッ素・・・淡黄色の気体
塩素 ・・・黄緑色の気体
臭素 ・・・赤褐色の液体
ヨウ素・・・黒紫色の固体
フッ素・塩素は、学校の実験でやるような場合では、なかなか色はみれません。
有毒なので、純度の高いものを狭い実験室で、こどもたちのいるところで、つくるのは安全責任取れないですしね。
〈余談ですが・・・〉
なぜ有毒なのかを明記している文献を探せなかったので、予想ですが、
ハロゲンは、価電子の関係から電子を奪いやすい特徴があるので、様々な物質と反応性が高いため、その反応性が良すぎることが有毒であることに結びついているのではないかと考えました。毒でいえば、薬も沢山摂取すれば、毒になると言われるように・・・。そう言ってしまうと、使用するときの純度によるのでは?とも考えられますね・・・。毒なんて、それだけじゃ認められないですよね。何かにとって害があるから=毒っていう、相対的なものだとしたら、単体で毒ということは、それだけ酸化力が強いとか、攻撃性があるということでしょうね・・・。わかったら、追記しますね。
原子番号が大きい物ほど融点・沸点が高い
ヨウ素>臭素>塩素>フッ素 の順で、融点・沸点がともに高い特徴があります。
これは、原子番号が大きくなるほど、分子間力が大きくなるからです。
固体>液体>気体 の順になっているので、納得しやすいと思います。
原子番号が小さいほど酸化作用が強い
二原子分子の話のときに、ハロゲン族元素の原子は、価電子を7個もっていると述べました。安定した電子配置になるためには、電子が1つ足りないですね。そのため、ハロゲン族元素の原子は1つ電子を受け取り、1価の陰イオンになりやすい特徴があります。
電子を受け取る力=電子を奪う力であり、
さらに言い換えると、
相手を酸化させる力=酸化力 と表現できます。
ハロゲンは、原子番号が小さいほど酸化作用が強いです。
なぜかというと、原子番号が小さいほど、原子核と最外殻電子との距離が小さいからです。
磁石で例えると、そのまま近づけるのと、紙や布を間に挟むのとではくっつき強さが変わるようなイメージですね。(わかりやすいかは、さておき・・・)
ほかの物質との反応
水との反応
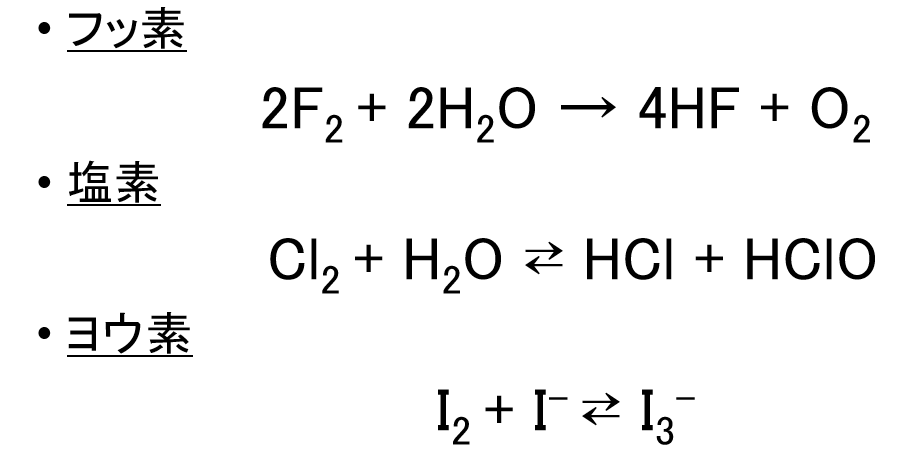
※塩素の反応式を訂正しました。
フッ素だけは、酸化作用が強すぎて、水を酸化してしまいますが、他の元素は水に溶けます。
塩素は、水中で塩化水素と次亜塩素酸が生じます。
ということはヨウ素液は、ヨウ素が水に溶けているから、ヨウ素水か・・・。
というと、違います。
ヨウ素は水に溶けにくく、ヨウ化カリウム水溶液には溶けます。
ヨウ素は、ヨウ化カリウムのイオンと反応して、三ヨウ化物イオンを生じて溶けます。
ハロゲン化水素
ハロゲンは水素と化合物を作り、ハロゲン化水素になります。
フッ化水素HF、塩化水素HCl、臭化水素HBr、ヨウ化水素HI
いずれも無色透明で、刺激臭のある気体で水に溶けやすい特徴があります。水溶性は全て酸性です。
フッ化水素は、フッ化カルシウム(CaF2)を濃硫酸(H2SO4)と一緒に加熱することで得られます。
塩化水素は、塩化ナトリウム(NaCl)に硫酸(H2SO4)を加えて加熱すると得られます。
濃硫酸があれば、加熱は要らないです。
それぞれの性質
F(フッ素)
名前の由来は、英語の fluorite(蛍石)から。
原子番号:9 原子量:19.00
融点:-219.62℃ 沸点:-188.14℃
密度:0.001696 g/cm3
常温・常圧における単体の状態:気体
発見された年代:1886年
・L殻に電子が7個あります。
フッ素は、単体では有毒ですが、虫歯予防やフライパンや傘にコーティング加工をするとものをくっつきにくくするお役立ちポイントがあります。
しかし、フッ素=虫歯予防で覚えるのは少し危険です。
昔、虫歯予防のために歯医者さんが、フッ化ナトリウム(無害)と間違えて、フッ化水素酸(有毒)を幼児の歯に塗布してしまい、死亡させてしまう事故がありました。直塗りってこわくね・・・。と思いますね。歯磨き粉のフッ素だけで十分だと思っちゃいますね。こわいこわい。
Cl(塩素)
名前の由来は、ギリシャ語のchloros(黄緑色)から。
原子番号:17 原子量:35.45
融点:-100.98℃ 沸点:-33.97℃
密度:0.003214 g/cm3
常温・常圧における単体の状態:気体
発見された年代:1774年
・M殻に電子が7個あります。
塩素には、漂白作用、殺菌作用があり消毒や漂白剤に使われています。
有毒なのに、大丈夫なの?と思いますが。消毒用の濃度なので大丈夫です。
また、塩素は水道水にも含まれています。塩素は、遊離塩素や残留塩素という項目で基準値が設けられています。浄水場で作られた水が我々の家まで届く間に、汚染されないように、塩素が私たちを守ってくれているのです。
一方で、危険にもさらしてくれています。
第一次世界大戦で使用された毒ガスが塩素です。
これは、家でも簡単に作れるんです。え?家に塩化ナトリウムと硫酸なんてないよ!とお思いのみなさま。漂白剤に酸素系と塩素系があるのはご存じでしょうか。
酸素系漂白剤と、塩素系漂白剤を混ぜると塩素が発生します。
純度は低いと思いますが、風呂場のような狭く閉ざされた環境で混ぜてしまうと、塩素によって中毒を起こしてしまうので、注意して下さい。
ちなみに、mamiwaは屋外でその実験をやったことがあります。その話は、また今度!
mamiwaは、黄緑色の塩素がみたくて理系を選んだのですが、怖すぎるし、なんやかんや塩素の実験なんてやる機会はないままです。色の付いている気体を見たいと、実験した先人たちはだいぶ命を削っていたようですが、欲をいえば見てみたいですよね。
ここだけの話、mamiwaが一番好きな元素は塩素です。(一番どうでもいい。)
Br(臭素)
名前の由来は、ギリシャ語のbromos(刺激臭・悪臭)から。
原子番号:35 原子量:79.80
融点:-7.3℃ 沸点:58.78℃
密度:3.1226 g/cm3(20℃)
常温・常圧における単体の状態:液体
発見された年代:1826年
・N殻に電子が7個あります。
海水中にも含まれているらしいです。
一番応用例で有名なのは、ブロマイドです。
銀との化合物である臭化銀は、写真の感光剤に使われています。デジタルではなく、アナログのカメラには欠かせないそうです。
I(ヨウ素)
名前の由来は、ギリシャ語のiodestos(紫)から。
日本語読みの「ヨウ素」は、ドイツ語のJod(ヨード)から。
原子番号:53 原子量:126.9
融点:113.6℃ 沸点:184.4℃
密度:4.93 g/cm3
常温・常圧における単体の状態:固体
発見された年代:1811年
・O殻に電子が7個あります。
ヨウ素といえば、ヨウ素デンプン反応。青紫色になるやつですね。
ヨウ素には、放射性ヨウ素という放射性物質があり、これは人体の甲状腺に溜まりやすい(集積しやすい)特徴があります。放射性ヨウ素はウランが核分裂するときにできます。原発事故があったときに、安全ヨウ素剤を服用してもらって、放射性ヨウ素が甲状腺に集積するのに対策したという話が有名です。服用には、注意が必要なので安易に手は出さないようにしましょう。(手だすひといないって。)
また、日本が世界有数のヨウ素の産出国であることはご存じでしょうか。
千葉県で取れるそうです。この話を知ってからmamiwaは、千葉=ヨウ素のイメージになりました。海藻によく含まれているそうです。
あとは、うがい薬に含まれています。有毒にならないような消毒剤の形で作られているので、毒性は大丈夫です。
At(アスタチン)
名前の由来は、ギリシャ語のastatos(不安定)から。
原子番号:85 原子量:-
融点:302℃ 沸点:337℃
密度:- g/cm3
常温・常圧における単体の状態:固体
発見された年代:1940年
・P殻に電子が7個あります。
ハロゲン族の中で、唯一放射性を持ち、天然で存在するのは微量なので、人工で合成されることのある元素です。
寿命が短く、すぐに崩壊してしまうそうです。不安定ですね。
医療分野で、活躍を期待されているが、不安定だから性質をなかなかあきらかにできず、未だ謎の多い元素なんだそうです。
名前が、アスタチンって可愛いと思います。アスカちゃんみたいな。
まとめ
ハロゲンは、有毒で有色の物質で、価電子が7個であるため、二原子分子で存在。
酸化作用が強い。
ハロゲン化水素は、水に溶けやすいく、同じく有毒である。
様々な分野で活躍しているが、扱いには十分注意が必要。
ーーーーーーーーーーーーーーーーーーーーーーーーーーーー
LINEスタンプ作ってます!mamiwaのLINEスタンプ販売中!
↑これが、一番使いやすくてオススメです!