mamiwaです。
今回はCOD(化学的酸素要求量)を解説します。
酸化還元反応を利用して、水中にある有機物の量を測定する方法です。
COD測定の原理と測定方法をメインに解説していきたいと思います。
高校の実験室で十分実験可能な測定方法ですので、自由研究や学校の授業でやってみてほしいですね。mamiwaは、高校時代にクラブ活動で年がら年中実験していました。
CODとは
CODはChemical Oxygen Demandの頭文字をとり、日本語では「化学的酸素要求量」と呼ばれています。
化学的〇〇があるなら、生物的〇〇もあるのでは?と思ったあなた!その通り。
似ている名前で「BOD」(生物化学的酸素要求量)という測定方法もあります。それは、また今度紹介したいと思います。
CODは、主に水質項目で、環境測定の指標として使われることがあります。
環境基本法の「水質汚濁にかかる環境基準」は、「人の健康保護」に関するものと、「生活環境の保全」に関する環境基準の2つに分けられています。
CODは、「生活環境の保全」に関する環境基準の中でも「湖沼」の環境基準の項目となっていて、湖沼のタイプによって、基準値が設定されています。
CODの値が大きいほど、水中の有機物量が多いことになり、汚れていると評価します。参考文献→環境省HPより 水質汚濁にかかる環境基準
原理
先に測定方法を知りたい方は、長くなりますのでスキップしてくださいね。
COD(化学的酸素要求量)の、「化学的」とは何かというと、冒頭で触れた通り、「酸化還元反応」を利用しているところです。
原理を説明します。
水中には、目に見えない微生物などの有機物が沢山あります。それらを無理矢理、酸化するのに要した酸化剤の量を酸素量に換算するとCOD値が求まります。
といっても、よく分からないですよね。
実際に使う試薬を見ながら、考えてみましょう。
〈使用する試薬〉
酸化剤:過マンガン酸カリウム水溶液
還元剤:シュウ酸ナトリウム水溶液
過マンガン酸カリウムは、とても強い酸化剤です。これを、有機物のある試料(調査に使いたい水のこと)に入れると、どうなるでしょうか?
一定量の過マンガン酸カリウムを入れると、そのうちのいくらかが有機物を酸化するのに使われ、使われなかった一部は残ります。
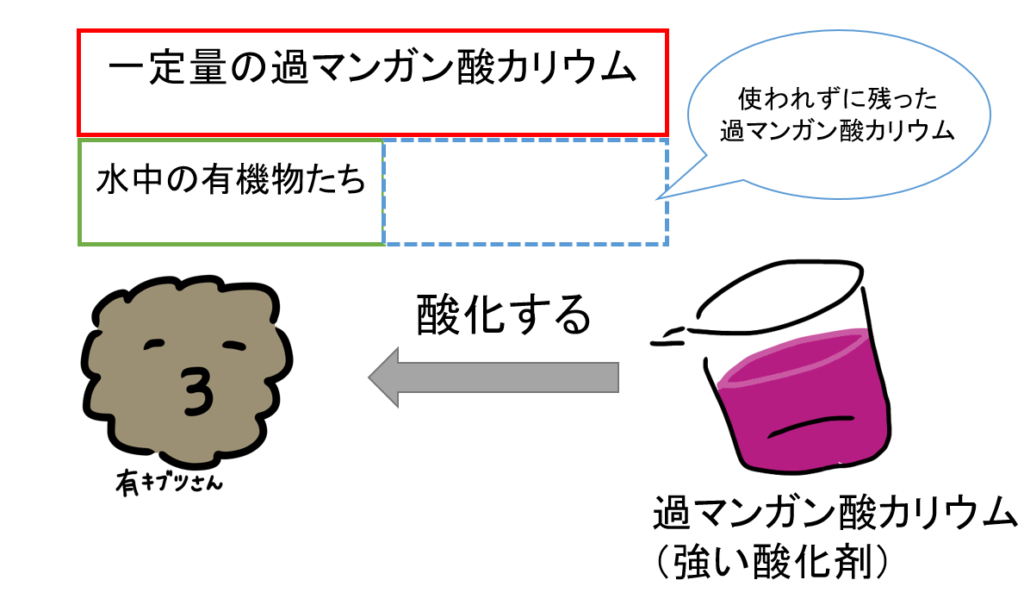
次に、初めに加えた過マンガン酸カリウムと同じ量のシュウ酸ナトリウムを加えます。
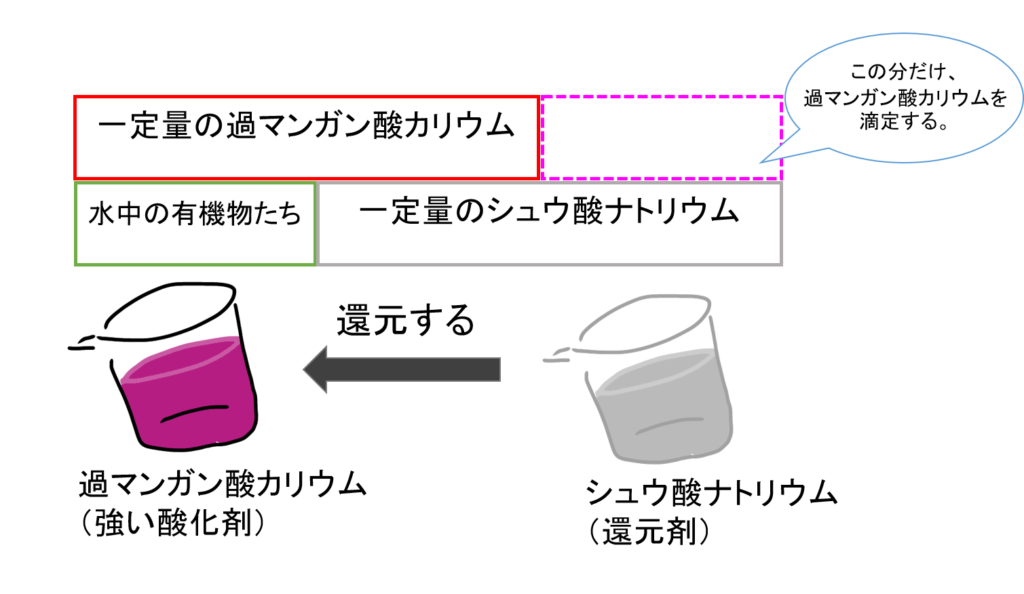
そうすると、使われなかった過マンガン酸カリウムが、加えられたシュウ酸ナトリウムによって、還元されます。
このままでは、シュウ酸ナトリウムが余分に存在したままになってしまいますね。
求めたいのは、何だったでしょうか。そうです、有機物の量でしたよね。
有機物の量は、初めに反応した過マンガン酸カリウムの量を酸素量に換算すればよい。
では、やることは一つ。
余分にあるシュウ酸ナトリウムと反応するだけの量の過マンガン酸カリウムを加えればよいのです。
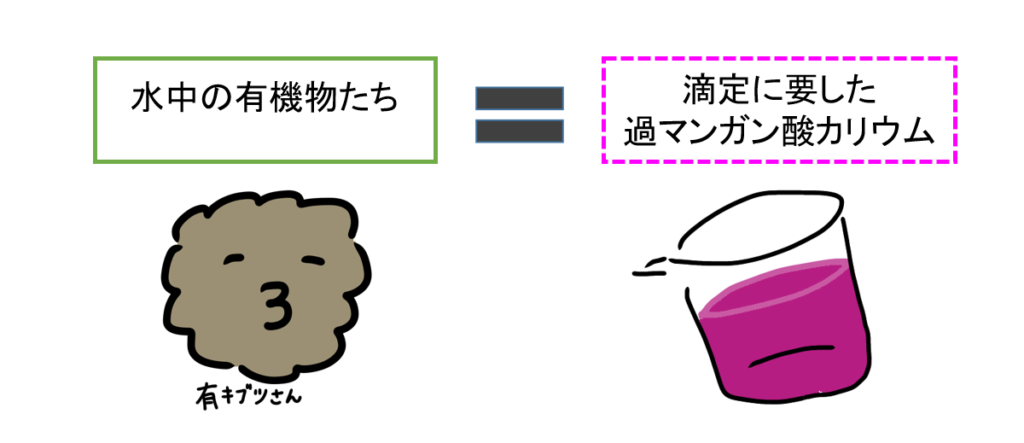
こうすることで、元々どれだけ入っていたのか分からなかった有機物の量(有機物を消費するのに要した酸素量)が求まるようになります。
試薬を使用することで、化学的に有機物の量を特定する方法です。
測定方法
必要なもの(試料、試薬、道具)
〈試料〉
・測定に使いたい液体
→あまりにも汚そうだったら希釈しておいた方がいいです。
・純水(イオン交換水)→空試験用に使う
〈試薬〉
・硫酸→過マンガン酸カリウムは硫酸酸性下でないと反応しないため
・硝酸銀水溶液(濃いめのもの)→水中の塩素を沈殿させるため
・過マンガン酸カリウム水溶液(5mmol/L)
・シュウ酸ナトリウム水溶液(12.5mmol/L)
〈道具〉
・三角フラスコ300mL
・ビーカー500mL
・ホールピペット10mL
・安全ピペッター
・駒込ピペット
・ビュレット50mL
・メスシリンダー
・ホットプレート
*加熱セット
・三脚 ・金網 ・ガスバーナー ・耐熱板 ・チャッカマン、ライター
もしあれば、
・撹拌子とホットスターラー
測定手順
①メスシリンダーを用いて試料を100mLとり、300mL三角フラスコに入れる。
② ①に駒込ピペットやメスシリンダーを用いて硫酸(1mol/L)を10mL加え、振り混ぜる。
→硫酸酸性条件にするためなので、ホールピペットで取る必要はありません。
③次に、硝酸銀水溶液を5mL加え、振り混ぜる。
→沈殿物がでてきても、そのままで大丈夫です。
④過マンガン酸カリウム水溶液(5mmol/L)を、ホールピペットを用いて10mL加え、振り混ぜる。
⑤加熱セットを用意して、500mLビーカーに水orお湯をいれて、ガスバーナーの火をつける。
⑥ ⑤が沸騰したら、④の三角フラスコを入れて30分間加熱する。
→もしも、過マンガン酸カリウム水溶液の紫色が消えてしまったら、それだけ試料中の有機物の量が多かったということになります。
⑦加熱後、三角フラスコを取り出し、シュウ酸ナトリウム水溶液(12.5mmol/L)をホールピペットを用いて10mL加える。
⑧ビュレットに過マンガン酸カリウム水溶液(5mmol/L)を入れ、目盛を調整する。
⑨三角フラスコをホットプレートの上に乗せながら、溶液の色が淡い赤色になるまで、滴定をする。(片手で、振り混ぜながら行いましょう。)
※1 ホットスターラーがあれば、撹拌子をいれて、撹拌しながら行うと楽です。
※2 まず、純水をサンプルにした三角フラスコから行いましょう。
⑩淡い赤色になったところを終点として、目盛をよみ滴下量を出す。
⑪以下の式に値を代入して、COD値を算出する。

b・・・空試験での滴下量 です。
〈ファクターとは・・・〉
試薬を調製する際に、どれだけ丁寧に調製したとしても、完璧に目的の濃度になっているとは言い切れません。また、日を置くと目的の濃度からずれてしまっていることもあります。そうなると、試薬の濃度が変わり、測定値にも誤りがでてしまうため、真の値/目的の値 でファクターをとる必要があるのです。
過マンガン酸カリウムの真の濃度を別実験で算出しておきましょう。
詳しくは、5.高校化学でわかるポイントに書きます。
評価方法
CODの値が計算できたら、水のきれいさの目安で比較してみましょう。
表1.水質と魚の関係
|
生息できる種類 |
COD値[mg/L] |
|
いわな、やまめ |
1 |
|
鮎 |
3 |
|
鯉、鮒 |
5 |
|
魚は住めない |
>10 |
測定に使用した液体のCOD値と、環境基準で比較したり、同じような見た目でも、場所によって(日向にある池と、日陰にある池など)比較したりしてみても面白いと思います。
高校化学でわかるポイント
ファクターに用いる真の濃度の計算方法
酸化還元反応で、よく計算する量的関係はどう考えたらよいのか。
簡単にいうと、電子の受け渡し量が等しくなるときが過不足無く反応した点になります。
同じ濃度、体積だけ入ればよいという訳ではないのです。電子に注目します。
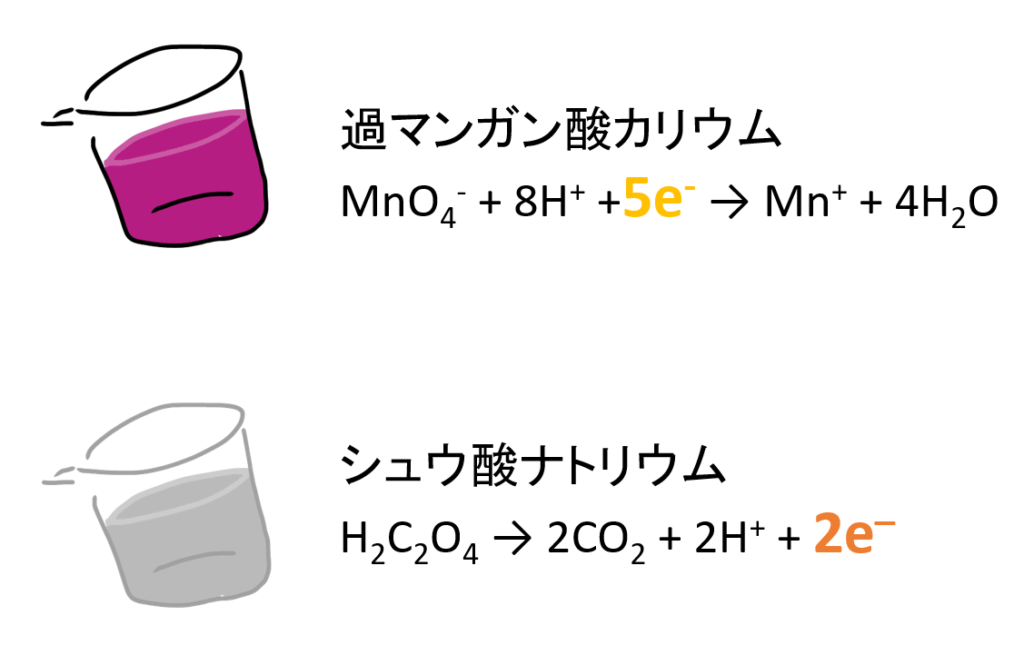
係数を利用して、等式をつくると以下の式になります。

このようにして、算出した過マンガン酸カリウム溶液の真の濃度をファクターの式に代入して、ファクターを出しましょう。
硝酸銀をいれるのはなぜ?
CODは、細かくいうと「還元性有機物の量」を測定する方法です。
水中に塩素があった場合、塩化物イオンが還元剤として働いてしまうため、加えたシュウ酸ナトリウムと反応したのかどうか怪しくなってしまいます。
硝酸銀水溶液を加えると、水中の塩化物イオンと銀イオンが結びつき、塩化銀が生成し、沈殿物として出てきます。
ですので、硝酸銀水溶液を加えたときに、白っぽい沈殿物が生じても慌てる必要はありません。
さいごに
とても長くなりましたが、いかがだったでしょうか。
COD測定は加熱作業があるため、大変時間がかかりますが、パックテストのような曖昧な調査結果よりも数値で比較できる点がいいなと思います。
いくら理論がわかっていても、実験によって手を動かすことで、教科書には書かれていないような小さな変化に気づき、なぜだろう、こういうことなのではないか、と考えることができます。
聞く→見る→手を動かす→考える→人に説明する→指摘を受ける というような手順を経て、人は人として成長していくような気がしています。
これは、読み物として楽しんでいただき、測定方法や評価方法は、ぜひ大きなホームページ(環境省などの信頼できる文献)を参照しながら、実験に取り組んでみて欲しいと思います。自宅でできる実験なんかも模索してみたいですね。
次回も 学校でできる環境測定を取り上げてみようと思いますので、お楽しみに!
参考になりましたら、👍やブックマーク登録よろしくお願いいたします。